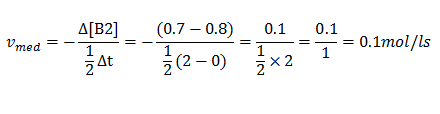Cinética química
Cinética é parte da química de estuda a velocidade das relações química.
Velocidade de consumo e velocidade de formação
Quando temos uma reacção química no decorrer do tempo observamos que os reagentes são comidos e os produtos são formados se quisemos saber com que velocidade isso ocorre podemos obter a partir da variação da concentração de cada reagente ou produto pela variação do tempo.

Grandezas e unidades
| Grandezas | Unidades | Outras unidades |
| Concentração | Mol por litro (mol/l) | Molar |
| Tempo | Segundo (s) | Minutos (min), horas (h) |
| Velocidade | mol/ls | M/s; mol/mim l; M/min… |
Se tivermos uma reacção química
aA+bB → cC+dD
E pretendemos saber a velocidade de consumo da substância A ,B podemos conforme dissemos pela variação da concentração e variação de tempo com que isso ocorre.
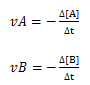
∆[A]→ variação da concentração da substância A
∆[B]→ variação da concentração da substância B
vA→ velocidade media de consumo da substância A
vB→ velocidade media de consumo da substância B
∆t → variação do tempo
O sinal menos (-) e devido ao facto dessas substâncias estarem a serem consumidas. (os reagentes levam sempre sinal negativo).
De forma análoga podemos também obter a velocidade de formação da substância C e D;
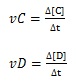
∆[C]→ variação da concentração da substância C
∆[D]→ variação da concentração da substância D
vC→ velocidade media de formação da substância C
vD→ velocidade media de formação da substância D
Representação gráfica das concertações
aA+bB → cC+dD
Dissemos que as substâncias A e B são consumidas ao longo de tempo isso significa que suas concentrações diminuem.
As substâncias C e D são formadas no decurso da reacção o que Quer dizer que suas concentrações aumentam no decorrer do tempo.

Velocidade média da reacção
Já sabemos calcular a velocidade de consumo e de formação agora como calcular a velocidade média da própria reacção?
No cálculo da velocidade média da reacção nos levamos em cota os coeficientes estequiometricos das substâncias e pode ser calculada usando qualquer uma das substâncias envolvidas na reacção.
aA+bB → cC+dD
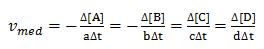
vmed→ velocidade media da reacção.
Aplicação
Durante a decomposição da água oxigenada sua concentração varia de 0.2mol/l para 0.15mol/l durante os instantes de 20 e 30segundos calcule a velocidade media do seu consumo.
Resolução
A velocidade media de consumo da agua oxigenada e dada por;
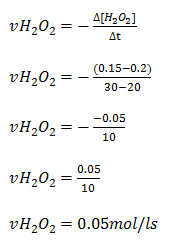
2.Sabendo que a velocidade media de formação do amoníaco (NH3) e de 0.12mol/ls determine;
N2+3H2 –> 2NH3
a)a velocidade media de consumo de N2
b)a velocidade media de consumo de H2
c) a velocidade media da reacção
Resolução
A velocidade media de consumo de N2 e dada por;
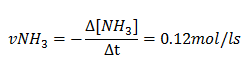
Porem não temos a sua concentração mais como temos a velocidade de formação de NH3 significa que;
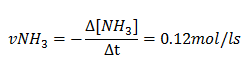
Vamos usar relações estequiometricas;
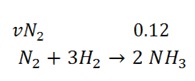
Sabemos que vNH3=0.12mol/ls
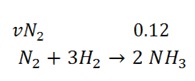
Dai podemos dizer que
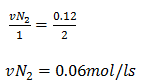
b)vamos aplicar o mesmo procedimento
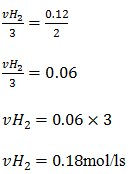
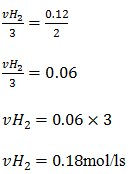
c) a velocidade media reacção e dada por:

Com isso podemos dizer que;
3. Com base na reacção a baixo obtivesse a seguinte tabela
Tempo (s) | [A2] | [B] | [A2B] |
0 | 0.8 | ||
2 | 0.6 | 0.7 | |
4 | 0.1 | ||
6 | 0.45 |
a)Preencha a tabela
b)Calcule a velocidade média de consumo de A2 nos instantes 2 a 4 segundos
c) Calcule a velocidade média da reacção nos instantes 0 a 2 segundos
Resolução
Para preencher a tabela vamos se auxiliar em variações da concentração
Tempo (s) | [A2] | [B] | [A2B] |
0 | 0.8 | ||
∆[1] | |||
2 | 0.6 | 0.7 | |
∆[2] | |||
4 | 0.1 | ||
∆[3] | |||
6 | 0.45 |
No inicio (quanto t=os) [A2B]=0 pois ainda não iniciou a sua formação
Tempo (s) | [A2] | [B] | [A2B] |
0 | 0.8 | 0 | |
∆[1] | |||
2 | 0.6 | 0.7 | |
∆[2] | |||
4 | 0.1 | ||
∆[3] | |||
6 | 0.45 |
Para o [A2] ∆[1]=0.6-0.8=-0.2
Tempo (s) | [A2] | [B2] | [A2B] |
0 | 0.8 | 0 | |
∆[1] | -0.2 | ||
2 | 0.6 | 0.7 | |
∆[2] | |||
4 | 0.1 | ||
∆[3] | |||
6 | 0.45 |
Agora vamos calcular ∆[1] para B2 e [A2B]
Uma mol de A2 forma ½ mol de B2
1mol de A2→½mol de B2
0.2→∆[ B2]
∆[ B2]= ½ ×0.2=0.1
E Uma mol de A2 forma uma mol de A2B
1mol de A2→1mol de A2B
0.2→∆[ A2B]
∆[ A2B]=0.2
Para o [A2] ∆[1]=0.6-0.8=-0.2
Tempo (s) | [A2] | [B2] | [A2B] |
0 | 0.8 | 0 | |
∆[1] | -0.2 | –0.1 | 0.2 |
2 | 0.6 | 0.7 | |
∆[2] | |||
4 | 0.1 | ||
∆[3] | |||
6 | 0.45 |
O sinal menos (para B2 ) é devido ao faço de estar a ser consumido (nos reagentes sempre colocaremos sinal negativo pois estão a ser consumido)
Vamos calcular a [B2] quanto t =0s
[B2]=0.7-(0.1)=0.8
Vamos calcular [A2B] quanto t=2s
[A2B]=0.2+0=0.2
Tempo (s) | [A2] | [B2] | [A2B] |
0 | 0.8 | 0.8 | 0 |
∆[1] | -0.2 | –0.1 | 0.2 |
2 | 0.6 | 0.7 | 0.2 |
∆[2] | |||
4 | 0.5 | ||
∆[3] | |||
6 | 0.45 |
Vamos calcular ∆[2] para [A2B]
∆[2]=0.5-0.2=0.3
Tempo (s) | [A2] | [B2] | [A2B] |
0 | 0.8 | 0.8 | 0 |
∆[1] | -0.2 | –0.1 | +0.2 |
2 | 0.6 | 0.7 | 0.2 |
∆[2] | +0.3 | ||
4 | 0.5 | ||
∆[3] | |||
6 | 0.45 |
Agora vamos calcular ∆[1] para A2 e B2
Uma mol de A2B forma uma mol de A2
1mol de A2B →A2 mol de B2
0.3→∆[ A2]
∆[ A2]= 0.3
Uma mol de A2B forma ½ mol de B2
1mol de A2B →½mol de B2
0.3→∆[ B2]
∆[ B2]= ½ ×0.3=0.15
Tempo (s) | [A2] | [B2] | [A2B] |
0 | 0.8 | 0.8 | 0 |
∆[1] | -0.2 | –0.1 | +0.2 |
2 | 0.6 | 0.7 | 0.2 |
∆[2] | -0.3 | -0.15 | +0.3 |
4 | 0.5 | ||
∆[3] | |||
6 | 0.4 |
Vamos calcular a [B2] e [A2B] quanto t =4s
[A2]=0.6-0.3=0.3
[B2]=0.7-0.15=0.55
Tempo (s) | [A2] | [B2] | [A2B] |
0 | 0.8 | 0.8 | 0 |
∆[1] | -0.2 | –0.1 | +0.2 |
2 | 0.6 | 0.7 | 0.2 |
∆[2] | -0.3 | -0.15 | +0.3 |
4 | 0.3 | 0.55 | 0.5 |
∆[3] | |||
6 | 0.45 |
Vamos calcular ∆[3] para [B2]
∆[3]=0.55-0.45=0.1
Tempo (s) | [A2] | [B2] | [A2B] |
0 | 0.8 | 0.8 | 0 |
∆[1] | -0.2 | –0.1 | +0.2 |
2 | 0.6 | 0.7 | 0.2 |
∆[2] | -0.3 | -0.15 | +0.3 |
4 | 0.3 | 0.55 | 0.5 |
∆[3] | -0.1 | ||
6 | 0.45 |
Agora vamos calcular ∆[3] para A2 e A2B
½ mol de B2 forma uma mol de A2
½ mol de B2 →1 mol de A2
0.1→∆[ A2]
∆[ A2]= 0.1×2=0.2
½ mol de B2 →1 mol de A2B
0.1→∆[ A2B]
∆[ A2B]= 0.1×2=0.2
Tempo (s) | [A2] | [B2] | [A2B] |
0 | 0.8 | 0.8 | 0 |
∆[1] | -0.2 | –0.1 | +0.2 |
2 | 0.6 | 0.7 | 0.2 |
∆[2] | -0.3 | -0.15 | +0.3 |
4 | 0.3 | 0.55 | 0.5 |
∆[3] | -0.2 | -0.1 | 0.2 |
6 | 0.45 |
Vamos calcular a [A2] e [A2B] quanto t =4s
[A2]=0.3-0.2=0.1
[A2B]=0.5+0.2=0.7
Tempo (s) | [A2] | [B2] | [A2B] |
0 | 0.8 | 0.8 | 0 |
∆[1] | -0.2 | –0.1 | +0.2 |
2 | 0.6 | 0.7 | 0.2 |
∆[2] | -0.3 | -0.15 | +0.3 |
4 | 0.3 | 0.55 | 0.5 |
∆[3] | -0.2 | -0.1 | 0.2 |
6 | 0.1 | 0.45 | 0.7 |
Resposta a nossa tabela depois de preenchida fica;
Tempo (s) | [A2] | [B2] | [A2B] |
0 | 0.8 | 0.8 | 0 |
2 | 0.6 | 0.7 | 0.2 |
4 | 0.3 | 0.55 | 0.5 |
6 | 0.1 | 0.45 | 0.7 |
b) a velocidade média de consumo de A2 nos instantes 2 a 4 segundos é dada por
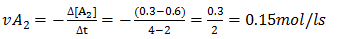
c) a velocidade média da reacção nos instantes 0 a 2 segundos pode ser obtida por qualquer uma das expressões
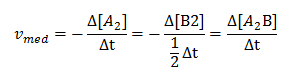
Irei usar