11. Num recipiente contendo uma substância A, foram adicionadas gotas de fenolftaleína, dando uma coloração rósea. Adicionando-se uma substância B em A, a solução apresenta-se incolor. Com base nessas informações podemos afirmar que:
a) A e B são ácidos.
b) A e B sáo sais.
c) A e B săo bases.
d) A é um ácido e B é uma base.
e) A é uma base e B é um ácido.
Resposta : A é uma base e B é um ácido.
12. Compostos de HF, NH3 e H30 apresentam pontos de fusão e ebulição maiores quando comparados com H2S e HCI, por exemplo, devido às:
A. As forças de London.
B. pontes de hidrogénio.
C interacções electrostáticas.
D forças de Van Der Waals.
Resposta. Os Compostos de HF, NH› e H30 apresentam pontos de fusão e ebulição maiores quando comparados com H2S e HCI, por exemplo, devido às pontes de hidrogénio.
13. 0 que você faria para aumentar a velocidade de dissolução de um comprimido efervescente em água?
I) Usaria água gelada. II) Usaria água a temperatura ambiente.
III) Dissolveria o comprimido inteiro. IV) Dissolveria o comprimido em 4 partes. Assinale das alternativas abaixo a que responde correctamente à questão.
A I e IV. B I e III. C III. D II e IV.
Para aumentar a velocidade de dissolução de um comprimido efervescente em água Usaria água a temperatura ambiente e Dissolveria o comprimido em 4 partes
14. A reacção A + 2 B se processa em uma única etapa. Qual a velocidade desta reacção quando K=0,3 L/mol
min, [A] = 2,0 M e [B] = 3,0 M ?
A 5,4. B 4,5. C 1,8. D 18,0.
V=k[A][B]
V=0,3•2•3
V=0,6•3
V=1,8
15. A tabela abaixo indica valores das velocidades da reaşão e as correspondentes concentrações em mol/L dos reagentes em idênticas condições, para o processo químico representado pela equação:
3 X + 2 Y → Z + 5 W
|
V(mol/litro min) |
[X] |
[Y] |
|
10 |
5 |
10 |
|
40 |
10 |
10 |
|
40 |
10 |
20 |
A equação da velocidade é
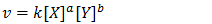
Temos que determinar os valores dos coeficientes a e a para isso usar os dados do experimento.
Para calcular o valor de x vamos dividir os dados da experiência 1 pelos dados da experiência 2.
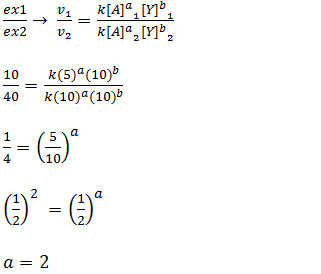
Para calcular o valor de b vamos dividir os dados da experiência 2 pelos dados da experiência 3.

Agora que sabemos que a=2 e b=2 podemos escrever a equação da velocidade como sendo;

16.Nas condições ambientes, é exemplo de sistema em estado de equilíbrio uma:
A Chávena de café bem quente.
B garrafa de água mineral gasosa fechada.
C porção de água fervendo em temperatura constante.
D tigela contendo feijão cozido.
Resposta Nas condições ambientes, é exemplo de sistema em estado de equilíbrio uma garrafa de água mineral gasosa fechada pois a temperatura não haverá troca de calor {veja aula sobre equilíbrio químico}
17. Em um recipiente de volume V ocorre a seguinte reacção de equilíbrio em fase gasosa:
A + B<=>2C. No início são colocados 6,5 mols de cada reagente e após atingido o equilíbrio, restaram 1,5 mols de cada reagente. A constante de equilíbrio (Kc) é igual a:
A 45 V B 22,2 V C 44,4 V2 D 44,4
A constante de equilíbrio (Kc) obtido a partir da formula;

Vamos fazer uma tabela para determinar O numero de moles no equilíbrio
|
|
Nmol(A) |
Nmol(B) |
Nmol(C) |
|
Inicio |
6,5 |
6,5 |
0 |
|
∆ |
|
|
|
|
Equilíbrio |
1,5 |
1,5 |
|
∆=6,5moles-1,5moles=5moles
|
|
Nmol(A) |
Nmol(B) |
Nmol(C) |
|
Inicio |
6,5 |
6,5 |
0 |
|
∆ |
5 |
5 |
|
|
Equilíbrio |
1,5 |
1,5 |
|
1 mol A—2mol C
Então 5 mol de A —10 mol de C
|
|
Nmol(A) |
Nmol(B) |
Nmol(C) |
|
Inicio |
6,5 |
6,5 |
0 |
|
∆ |
5 |
5 |
10 |
|
Equilíbrio |
1,5 |
1,5 |
10 |

Veja uma sobre Calculo da constante de equilíbrio químico
18. Nas células, tem-se o equilíbrio:
Glicose <=> Frutose ; Kc=0.42
Quando a concentração em quantidade de matéria de glicose for 0,10 mol/L, a de frutose será: A 0,042 mol/L. B 0,083 mol/L. C 0,23 mol/L. D 0,33 mol/L.

Resposta: Quando a concentração em quantidade de matéria de glicose for 0,10 mol/L, a de frutose será 0,042 mol/L
19. Refrigerantes possuem grande quantidade de gás carbónico dissolvido. A equação a seguir representa a, simplificadamente, o equilíbrio envolvendo esse gás em solução aquosa:
CO2(g)+H20(l)<=>HCO(aq)+H+(aq)
0 Equilíbrio é deslocado para a direita, quando se adiciona:
A ácido sulfúrico. B sacarose. C ácido acético. D hidróxido de sódio.
0 Equilíbrio é deslocado para a direita, quando se adiciona hidróxido de sódio. (Veja aula sobre descolamento do equilíbrios)
20. Um suco de tomate tern pH=4, isto significa:
A 0 suco tem propriedades alcalinas.
B a concentração de iões H3O+presentes no suco é de 10⁴mol/L
C a concentração de iões H3O+ presentes no suco é de 10-⁴ mol/L.
D a concentração de iões OH” presentes no suco é de 10-⁴ mol/L
Resolução
Ph=-log[H30]
4=-log[H30]
log[H30]=-4
[H30]=10-⁴
Resposta a concentração de iões H3O+ presentes no suco é de 10-⁴ mol/L.
Resultados dos exames de admissão ao Ensino Técnico Profissional 2026 já estão disponíveis
Os resultados dos exames de admissão ao Ensino Técnico Profissional (ETP) 2026 já estão disponíveis …
Resultados up 2026 (Já estão disponíveis)
Resultados dos Exames de Admissão da UP 2026 Os resultados dos exames de admissão à Universidade Ped…
Resolução de Exames de Matemática Admissão ISCISA 2019
Resolução de Exames de Matemática 2019 Admissão ao instituto superior de Ciências de saúde (ISCISA)&…
Resolução de exame de Matemática admissão a Academia Militar
Resolução de exame de Matemática 2018 admissão a Academia Militar 1. Considere o conjunto M = {x: x …
Resolução de Exames de Matemática Admissão UP 2018
1.Três camisas e cinco gravatas custam 4.600,00 Mt, duas camisas e três gravatascustam 3.000,00 Mt. …
Resolução de Exames de Química Admissão ISCISA 2019
1. Indique a alternativa FALSA: A. A água, o açúcar e o sal (dissolvidos) constituem um sistema mono…






