Equilíbrio químico
Para que se verifique o equilíbrio químico é necessário que tenhamos um sistema fechado e com temperatura constante.
Reacção irreversível
Reacção irreversível é aquela que ocorre no único sentido.
Reacção reversível
Reacção irreversível é aquela que ocorre em dois sentidos ao mesmo tempo.
Exemplo; X(g)+Y(g)↔K(g)+Z(g)
X(g)+Y(g)→K(g)+Z(g) reacção directa
K(g)+Z(g) →X(g)+Y(g) reacção inversa
Características do equilíbrio químico
– As concentrações das substâncias nela contidas (reagentes e produtos permanecem constates).
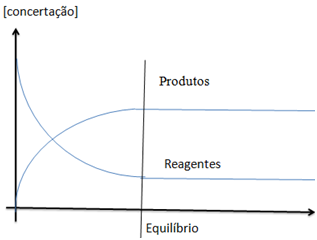
– A velocidade da reacção inversa é igual a velocidade da reacção directa.
Lei de equilíbrio químico
Seja dado a reacção a seguir que ocorre a uma temperatura constante e em um sistema fechado
aA(g)+bB(g)↔cC(g)+dD(g)
Vamos escrever a velocidade da reacção direita assim como da reacção reversa

Dissemos que no equilíbrio a velocidade da reacção direita e igual a velocidade da reacção inversa.
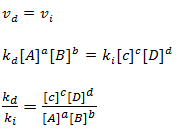
Sendo ki e kd cantantes a sua divisão ira resultar numa nova constate a qual chamaremos de constante de equilíbrio
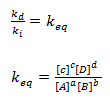
Aplicação
1.Dada a equação A2(g)+B(g)↔A2B(g) sabendo que no equilíbrio as concentrações são [A]=0,3mo/l ,[B]= 0,12mo/l e [A2B]=0.5mol/l determine
a)O valor da constate de equilíbrio
b) A sua unidade.
Resolução
Primeiro vamos escrever a equação da constante de equilíbrio para esta reacção

a)Vamos substituir pelos respectivos valores das concentrações

keq=1.38
b)Para descobrir a unidade da constate d equilíbrio vamos na equação de equilíbrio substituir pelas respectivas unidade

2. Quatro (4) moles de ácido clorídrico (HCl) são dissolvidos em um recipiente de 8 litros, no equilíbrio temos apenas 1.6 moles desse ácido.
2HCl(g)↔H2(g)+Cl2(g)
a)Calcule as concentrações de todas substâncias no equilíbrio
b)Calcule o valor da constate de equilíbrio
Resolução
Com o numero de moles e o volume do acido clorídrico vamos calcular a concentração do mesmo no inicio e no equilíbrio
No incido
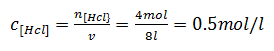
No equilíbrio
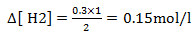
Vamos fazer uma tabela com os dados no inicio e no equilíbrio
| [HCl] mol/l | [H2] mol/l | [Cl2] mol/l | |
| Inicio | 0.5 | ||
| ∆[] | |||
| Equilíbrio | 0.2 |
No inicio [H2]=0mol/l e [Cl2]=0mol/l pois ainda não tínhamos dissolvido nada.
Podemos calcular ∆[] para o acido clorídrico uma vez que temos a sua concentração no inicio e no equilíbrio
∆[]=0.2-0.5=-0.3
| [HCl] mol/l | [H2] mol/l | [Cl2] mol/l | |
| Inicio | 0.5 | 0 | 0 |
| ∆[] | -0.3 | ||
| Equilíbrio | 0.2 |
De acordo com a equação 2HCl(g)↔H2(g)+Cl2(g) sabemos que;
2 moles de HCl→1mol de H2
0.3→∆[ H2]
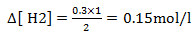
2 moles de HCl→1mol de Cl2
0.3→∆[ Cl2]
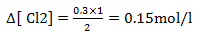
Vamos continuar preenchendo a tabela com esses valores
| [HCl] mol/l | [H2] mol/l | [Cl2] mol/l | |
| Inicio | 0.5 | 0 | 0 |
| ∆[] | -0.3 | 0.15 | 0.15 |
| Equilíbrio | 0.2 |
Para finalizar o preenchimento da tabela valor achar;
Equilíbrio
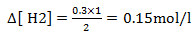
| [HCl] mol/l | [H2] mol/l | [Cl2] mol/l | |
| Inicio | 0.5 | 0 | 0 |
| ∆[] | -0.3 | 0.15 | 0.15 |
| Equilíbrio | 0.2 | 0.15 | 0.15 |
R; no equilíbrio [HCl]=0.2mol/l , [H2]=0.15mol/l e , [Cl2]=0.15mol/l
b) Vamos escrever a equação de equilíbrio para esta reacção
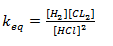
Vamos substituir pelo vamos das concentrações no equilíbrio
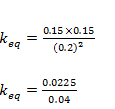
keq=0.5625
3.Colocou-se 1mol de HI no recipiente de 5litros verificou-se o equilíbrio 2HI(g) ↔H2(g)+I2(g) constatou se que k=16 determine o valor de todas concentrações no equilíbrio.
No incido
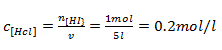
Sabemos que no inicio [H2]=0mol/l e [I2]=0mol/l com esses dados vamos formar uma tabela
| [HI] mol/l | [H2] mol/l | [I2] mol/l | |
| Inicio | 0.2 | 0 | 0 |
| ∆[] | |||
| Equilíbrio |
Como HI é um reagente sabemos que sua concentração vai diminuir vamos considerar que tenha diminuído “x” mol/l .
| [HI] mol/l | [H2] mol/l | [I2] mol/l | |
| Inicio | 0.2 | 0 | 0 |
| ∆[] | x | ||
| Equilíbrio |
Então para HI no equilíbrio teremos uma concentração igual a 0.2-x
| [HI] mol/l | [H2] mol/l | [I2] mol/l | |
| Inicio | 0.2 | 0 | 0 |
| ∆[] | x | ||
| Equilíbrio | 0.2-x |
De acordo com a reacção 2HI ↔H2+I2
2 moles de H→1mol de H2
x→∆[ H2]

2 moles de HCl→1mol de I2
x→∆[ I2]
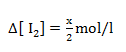
| [HI] mol/l | [H2] mol/l | [I2] mol/l | |
| Inicio | 0.2 | 0 | 0 |
| ∆[] | x | ||
| Equilíbrio | x-0.2 |
No equilíbrio
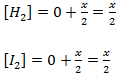
| [HI] mol/l | [H2] mol/l | [I2] mol/l | |
| Inicio | 0.2 | 0 | 0 |
| ∆[] | x | ||
| Equilíbrio | x-0.2 |
De acordo com 2HI(g) ↔H2(g)+I2(g) a equação d constante de equilíbrio é
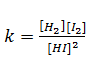
e no equilíbrio k=16 ;[HI] =x-0.2 ; [H2]=x/2 ; [I2]=x/2 vamos substituir esses valores na equação de equilíbrio
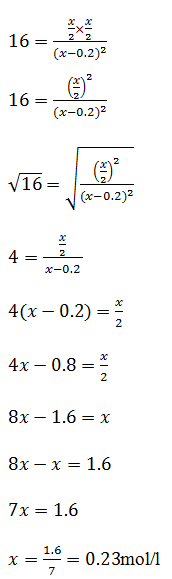
Dai podemos calcular todas concentrações no equilíbrio
| [HI] mol/l | [H2] mol/l | [I2] mol/l | |
| Equilíbrio | x-0.2=0.23-0.2=0.03 |
Interpretação do valor da constate de equilíbrio
Se keq>1 diz se que a reacção é espontânea e o equilíbrio esta dirigido no lado direito
Se keq<1 diz se que a reacção é forçada e o equilíbrio esta dirigido no lado esquerdo.
Constate de equilíbrio em função da pressão (kp)
O equilíbrio pode também ser expresso em função da pressão de igual modo como vimos anteriormente, apenas substituindo concentração por pressão.
Para a reacção aA(g)+bB(g)↔cC(g)+dD(g) kp e dado por;
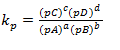
Onde;
pA→ Pressão de A
pB→ Pressão de B
pC→ Pressão de C
pD→ Pressão de D
Relação entre Kp e Kc
Para a reacção aA(g)+bB(g)↔cC(g)+dD(g) sabemos que;

Da equação dos gases PV=RTn podemos dizer

P=RT[]
pA=RT[A]
pB=RT[B]
pC=RT[C]
pD=RT[D]
Vamos substituir esses valores na expressão de kp


Aplicação
1.Seja dada a reacção 2A+B↔C no equilíbrio no equilíbrio pA=20atm, pB=5atm e pC=80atm determine ;
a)o valor de kp
Resolução
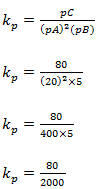
kp=0.04
2.Na equação 2N2O5(g)↔4NO2(g) + O2(g) qual é a relação entre kp e kc
Resolução
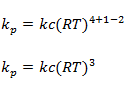
3.Para a reacção N2(g)+3H2(g)↔2NH3(g) decore o equilíbrio a sua temperatura de 20℃ determine o valor de kp sabendo que kc=48
Resolução

Teoria de ácido e base segundo Bronsted-Lowry
Ácido e base segundo Bronsted-Lowry Com as limitações apresentadas na definição de ácido e base segu…
Teoria de ácido e bases de Arrhenius
Ácido segundo Arrhenius Segundo Arrhenius ácido é qualquer substância que reagindo com água sofre io…
Força Relativa de um Ácido e uma Base em solução aquosa
Força Relativa de um Ácido A força relativa de um acido é determinada pela sua tendência de ceder pr…
Classificação da matéria e Métodos de separação de misturas
Classificação da matéria A matéria classifica-se em; – Substâncias puras -Misturas Substâncias…
Propriedades químicas, físicas, gerais, funcionais das substâncias
Propriedades químicas Uma espécie química é classificada de acordo com as suas propriedades que pode…
Factores que afectam o equilíbrio químico
Os factores que afectam o equilíbrio químico são; -Concentração -Temperatura -Pressão Concentração Q…
As bolas do mundial 2022 são recarregadas?
A bola do mundial 2022 tem um sensor de toque e movimento dentro dela, com o objectivo de fornecer i…
Movimento uniformemente variado
O que é movimento uniformemente variado Movimento uniformemente variado é aquele em que a veloc…
Movimento uniforme
Movimento uniforme Movimento uniforme é aquele em que a velocidade instantânea permanece c…
Queda livre e lançamento vertical para baixo e para cima
Queda livre Durante a queda livre os corpos realizam um movimente uniformemente variado com uma acel…
Lançamento oblíquo
Lançamento oblíquo Para melhor compreende esse movimento vamos analisar o seguinte esquema de um cor…
Lançamento horizontal
O que é lançamento horizontal O lançamento horizontal é um caso particular do lançamento oblíquo. Ne…
Movimento circular
Movimento circular Movimento circular é basicamente um movimento curvilíneo com raio const…
Força centrípeta e força elástica
Força centrípeta Quando um corpo realiza um movimento circular uniforme ela esta sujeita a uma acele…
Força de atrito e Plano inclinado
Força de atrito e Plano inclinado Nessa aula iremos bordar de orna pratica os conceito de força…













