Factores que afectam a velocidade das reacções químicas
Os factores que afectam a velocidade das reacções químicas são ;
– Superfície de contacto
– Concentração dos reagentes
– Temperatura dos reagentes
– Canalizadores
Superfície de contacto
Imaginemos que queremos cozinhar alimentos em uma panela e o fogo só entra em contacto com uma pequena parte da panela é claro que a cozedura ira demorar.
Com isso podemos concluir que quanto maior for a superfície de contacto maior será a velocidade da reacção química e quando menor for a superfície de contacto menor também será a velocidade.
Concentração dos reagentes
A velocidade das reacções químicas esta directamente ligado a concentração dos reagentes .
Temperatura dos reagentes
A velocidade das reacções químicas e a temperatura se relaciona pela expressão;

Canalizadores
Canalizadores substâncias usadas para acelerar as reacções químicas (não participam nas reacções)
Lei da velocidade
Dissemos que a velocidade é proporcional a concentração do dos reagentes e segundo Guldbeng-Waag pode ser escrita como sedo;

Onde;
v→ velocidade da reacção
k → Constante de velocidade
[R1]→ Concentração do reagente 1
[R2]→ Concentração do reagente 2
Para escrever a equação da velocidade só levamos em conta substâncias no estado gasoso e aquosa.
1.Dada a equação elementar aA(g)+bB (g)→ cC+dD determine a expressão da velocidade
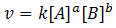
Aplicação
2.Para as equações abaixo determine a expressão da lei da velocidade
a)3A(g)+2B (g)→ cC

Nota; a substância A não entra pois esta no estado líquido. Na lei da velocidade só entram substâncias no estado gasoso e aquosa.
c)CaCO3(s)→Ca03(s)+CO2(g)
v=k
Ordem de una equação da velocidade
Ordem de una equação da velocidade corresponde a soma dos expoentes das substâncias obtidas na equação da velocidade.
Considere a equação 4HBr(g)+ O2(g)→H2O(g)+Br2(g)
Que se processa segundo os mecanismo;
HBr+O2→HBrO2 (etapa lenta)
HBrO2+HBr→2HBrO (etapa rápida)
HBrO+HBr→H2O+HBr2 (etapa rápida)
a) Escreve a equação da velocidade
b) Qual é a ordem
c) O que acontece se duplicamos a concentração de HBr
Resolução
a)Para escrever a equação da velocidade sempre consideramos a etapa lenta o que significa que vamos usar a etapa HBr+O2→HBrO2
v=k[Hbr][O2]
b)O expoente de HBR é um logo x=1 e o expoente de O2 também é um y=1 logo a reacção é de ordem x+y=1+1=2 a equação é de segunda ordem
c) Se duplicamos a concentração de HBr a nova velocidade será;
v2=k[2Hbr][O2]
v2=2k[Hbr][O2]
v2=2v
res; a velocidade duplica
Equações não elementares
Nas equações não elementares os coeficientes x e y da lei da velocidade devem ser obtidos por meio de cálculos.

Para a reacção entre H2 e NO, foram obtidos os seguintes valores experimentais: 2H2(g)+2NO(g)→ N2(g)+ 2H2O(l)
| Experiência | [H2] | [NO] | Velocidade |
| I | 0.001 | 0.001 | |
| II | 0.002 | 0.001 | |
| III | 0.002 | 0.002 |
Determine;
a)A equação da velocidade
b) A ordem
c)O valor da constante de velocidade
d)A unidade da constante de velocidade
Resolução
a)A equação da velocidade é
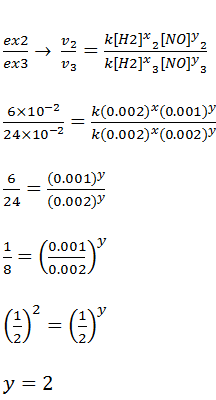
Temos que determinar os valores dos coeficientes x e y para isso usar os dados do experimento.
Para calcular o valor de x vamos dividir os dados da experiência 1 pelos dados da experiencia 2.

Para calcular o valor de y vamos dividir os dados da experiência 2 pelos dados da experiência 3.
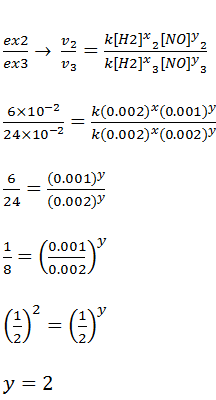
Agora que sabemos que x=1 e y=2 podemos escrever a equação da velocidade como sendo;
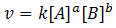
b)a ordem é a soma do expoentes x+y=1+2=3
Rep;Terceira ordem
c) já temos a lei da velocidade ,para determinar o valor da constante de velocidade basta na equação da velocidade substituir os valores (em um dos experimentos)
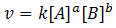
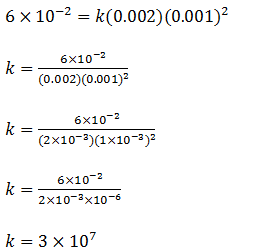
d) Para determinar a unidade da equação da velocidade vamos usar ;

Energia de activação
Existe uma energia mínima necessária para que as partículas comecem a reagir a qual chamamos de energia de activação quanto maior for essa energia mais rápida será a reacção.
Reacção exotérmica é aquela que se verifica com libertação de calor a energia dos reagentes e menor que a energia dos produtos logo ∆H <0.
Reacção endotérrmica é aquela que se verifica com absorção de calor a energia dos produtos é menor que a energia dos reagentes logo ∆H> 0.
Processo de uma reacção química

Onde
Ec→ Energia do complexo activado
Ea→ Energia de activação
Er→ Energia dos reagentes
Ep→ Energia dos produtos
∆H→ variação da etalpia
Aplicação
1.Com base no gráfico da reacção 3A(g)+2B (g)→ cC

Determine
a)Energia do complexo activado
b)Energia de activação
c)Energia dos reagentes
d)Energia dos produtos
e)Variação da etalpia
f)Diga se reacção é endotérrmica ou exotérmica
Resolução
Vamos representar todos pedidos no diagrama
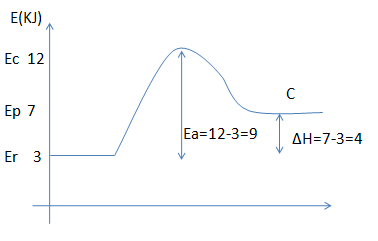
a)Energia do complexo activado é igual a 12kJ
b)Energia de activação é igual a 9kJ
c)Energia dos reagentes é igual a 3kJ
d)Energia dos produtos é igual a 7kJ
e)Variação da etalpia é igual a 4kJ
f)Como ∆H> 0 a reacção é endotérrmica
Teoria de ácido e base segundo Bronsted-Lowry
Ácido e base segundo Bronsted-Lowry Com as limitações apresentadas na definição de ácido e base segu…
Teoria de ácido e bases de Arrhenius
Ácido segundo Arrhenius Segundo Arrhenius ácido é qualquer substância que reagindo com água sofre io…
Força Relativa de um Ácido e uma Base em solução aquosa
Força Relativa de um Ácido A força relativa de um acido é determinada pela sua tendência de ceder pr…
Classificação da matéria e Métodos de separação de misturas
Classificação da matéria A matéria classifica-se em; – Substâncias puras -Misturas Substâncias…
Propriedades químicas, físicas, gerais, funcionais das substâncias
Propriedades químicas Uma espécie química é classificada de acordo com as suas propriedades que pode…
Factores que afectam o equilíbrio químico
Os factores que afectam o equilíbrio químico são; -Concentração -Temperatura -Pressão Concentração Q…
Sucessões (O que é um sucessão numérica)
Sucessão é uma sequência de números que obedece uma determinada lei de formação a qual chamamos de t…
Classificação de uma sucessão
Sucessão limitada Uma sucessão diz-se limitada se todos termos da sucessão estão compreendidos em de…
Progressão aritmética (PA)
O que é progressão aritmética ? Progressão aritmética é um tipo de sucessão em que a diferença entre…
Progressão geométrica (PG)
Progressão geométrica é um tipo de sucessão em que a razão entre os termos consecutivos é constante.…








